Показания
Ревматоидный артрит
Лечение ревматоидного артрита умеренной и высокой степени активности у взрослых (с 18 лет):
в комбинации с метотрексатом при недостаточном ответе на лечение базисными противовоспалительными препаратами (БПВП), включая метотрексат;
в качестве монотерапии при непереносимости или нецелесообразности дальнейшего лечения метотрексатом.
Было показано, что Симзия® при совместном применении с метотрексатом снижает прогрессирование повреждения суставов, оцениваемое с помощью рентгенографии, и улучшает физические функции.
Болезнь Крона
Лечение болезни Крона с умеренной и высокой степенью активности заболевания у взрослых при неэффективности терапии БПВП.
Аксиальный спондилоартрит
Препарат Симзия® показан для лечения тяжелого активного аксиального спондилоартрита у взрослых, включая:
тяжелый активный анкилозирующий спондилит при недостаточном ответе на лечение нестероидными противовоспалительными препаратами (НПВП) или при их непереносимости у взрослых;
тяжелый активный аксиальный спондилоартрит без рентгенологических признаков АС, но с объективными признаками воспаления, проявляющимися в повышении концентрации СРБ и/или с соответствующими изменениями при магнитно-резонансной томографии (МРТ), при недостаточном ответе на терапию НПВП или при их непереносимости.
Псориатический артрит
Лечение активного псориатического артрита у взрослых:
в комбинации с метотрексатом при недостаточном ответе на терапию БПВП;
в качестве монотерапии в случае непереносимости или нецелесообразности дальнейшего лечения метотрексатом.
сепсис или риск возникновения сепсиса, а также тяжелые хронические или локализованные инфекции в активной стадии (в т.ч. туберкулез, абсцесс, другие оппортунистические инфекции, включая грибковые (гистоплазмоз, кандидоз, аспергиллез, бластомикоз, кокцидиоидомикоз, нокардиоз, листериоз и др.)), пневмоцистные и вирусные инфекции, включая вирусный гепатит В в стадии реактивации;
сердечная недостаточность III-IV функционального класса по NYHA (классификация Нью-Йоркской ассоциации кардиологов);
детский и подростковый возраст до 18 лет;
одновременное применение анакинры, абатацепта и этанерцепта;
повышенная чувствительность к цертолизумаба пэголу или другим компонентам, входящим в состав препарата.
Применение при беременности и кормлении грудью
Женщинам репродуктивного возраста следует использовать надежные методы контрацепции во время лечения и в течение, по крайней мере, 10 недель после его окончания.
Активный трансплацентарный перенос иммуноглобулинов (IgG) происходит за счет связывания Fc фрагмента антитела с неонатальным Fc рецептором (FcRn). Цертолизумаба пэгол состоит только из Fab фрагмента антитела и не содержит Fc фрагмент. При проведении исследования репродуктивности на крысах было показано, что при беременности TN3 γ1 (полное суррогатное антитело к цертолизумабу пэголу, включающее Fc фрагмент) передавалось плоду. Однако TN3 PF (суррогатный Fab фрагмент антитела к цертолизумаба пэголу без Fc фрагмента) передавался плоду в незначительных или неподдающихся измерению количествах в сравнении с концентрацией фрагмента Fc в плазме крови матери, что свидетельствует о важной роли Fc фрагмента в трансплацентарном переносе.
Кроме того, подтверждающие эти наблюдения данные были получены in vitro с использованием модели замкнутого контура плацентарного транспорта человека. Было показано, что концентрация цертолизумаба пегола в контуре плода была ниже или около нижнего предела его количественного определения.
В рамках независимого клинического исследования у 10 пациенток с болезнью Крона, получавших препарат Симзия® при беременности, измерялась концентрация цертолизумаба пэгола в крови матерей, в пуповиной крови, а также в крови новорожденных (n=12) в день родоразрешения. Концентрация цертолизума пэгола была очень низкой в пуповинной крови (< 0.41-1.66 мкг/мл) и крови новорожденных (< 0.41-1.58 мкг/мл) по сравнению с концентрацией в материнской крови (1.87 - 59.57 мкг/мл). Концентрация ПЭГ (полиэтиленгликоля) была ниже предельного уровня определения во всех образцах пуповинной крови и крови новорожденных.
Доклинические и клинические данные позволяют судить об отсутствии активной FcRn - зависимой трансплацентарной передаче цертолизумаба пэгола.
Поскольку данные хорошо контролируемых исследований препарата Симзия® у беременных отсутствуют, его не следует применять при беременности за исключением случаев явной необходимости.
В связи с ингибированием фактора некроза опухоли (ФНОα), препарат Симзия®, применяемый при беременности, может повлиять на параметры нормального иммунного ответа новорожденного. Хотя концентрация цертолизумаба пэгола в крови младенцев низкая, клиническая значимость этих данных не ясна.
Соотношение риск/польза при использовании живых вакцин в течение первых 12 недель жизни младенца должно оцениваться педиатрами. Однако препарат Симзия® не подавляет гуморальный иммунный ответ при использовании неживых вакцин у взрослых.
У самцов грызунов были обнаружены уменьшение подвижности сперматозоидов и тенденция к снижению их числа без видимого влияния на фертильность животных.
В ходе клинического исследования по оценке воздействия цертолизумаба пегола на качественные показатели спермы (объем спермы, количество и концентрация сперматозоидов, прогрессивная подвижность, процент общей подвижности, жизнеспособность и морфология сперматозоидов) были обследованы 20 здоровых мужчин, которые рандомизированно получали однократную п/к инъекцию 400 мг цертолизумаба пэгола или плацебо. В течение 14 недель наблюдения не было выявлено воздействия цертолизумаба пэгола на качественные показатели спермы по сравнению с плацебо.
Не установлено, выделяется ли цертолизумаба пэгол с грудным молоком. Однако известно, что иммуноглобулины способны проникать в грудное молоко, поэтому риск для ребенка, находящегося на грудном вскармливании, не может быть устранен. Если лечение препаратом Симзия® необходимо в период лактации, грудное вскармливание следует прекратить.
Применение при нарушениях функции печени
Перед назначением препарата Симзия® пациенты должны пройти обследование для выявления вируса гепатита В. Пациентам, у которых результаты тестов на наличие вируса гепатита В оказались положительными, должна быть рекомендована консультация специалиста в лечении гепатита В.
Применение у детей
Противопоказан в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
В клинических исследованиях отмечена более высокая частота инфекционных заболеваний у пациентов в возрасте 65 лет и старше по сравнению с более молодыми пациентами, хотя эти данные ограничены. Рекомендуется соблюдать осторожность при применении препарата Симзия® у пожилых пациентов, особого внимания требуют пациенты этой группы в отношении возможного развития инфекции.рых заболеваниях дыхательных путей.
Применение и дозы
Препарат вводят п/к.
Лечение должно назначаться и контролироваться врачом, имеющим опыт в диагностике и лечении заболеваний, при которых показано назначение препарата Симзия®.
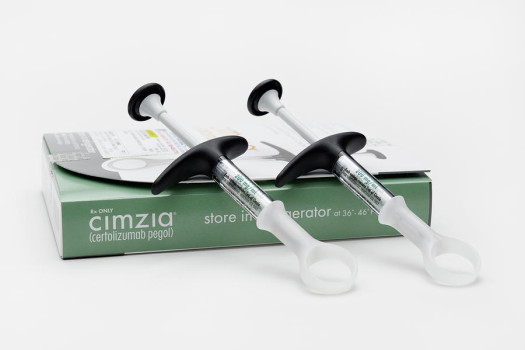
После надлежащего обучения пациента технике введения препарата врач может разрешить самостоятельное введение препарата (см. далее инструкцию по введению) с соответствующим медицинским наблюдением. Симзия® применяется в виде готового раствора для инъекций в дозировке 200 мг (одноразовый шприц, содержащий 1 мл цертолизумаба пэгола).
Индукционная доза
Рекомендуемая индукционная доза препарата Симзия® для взрослых пациентов составляет 400 мг в виде двух п/к инъекций по 200 мг в первый день лечения, на второй и на четвертой неделе лечения.
Поддерживающая доза
При болезни Крона после индукционной дозы рекомендованная поддерживающая доза препарата Симзия® для взрослых пациентов составляет 400 мг 1 раз в 4 недели.
При ревматоидном артрите после индукционной дозы рекомендованная поддерживающая доза препарата Симзия® для взрослых пациентов составляет 200 мг 1 раз в 2 недели. Для поддерживающего лечения заболевания возможно использование альтернативного режима дозирования 400 мг 1 раз в 4 недели.
При анкилозирующем спондилите после индукционной дозы рекомендованная поддерживающая доза препарата Симзия® для взрослых пациентов составляет 200 мг 1 раз в 2 недели или 400 мг 1 раз в 4 недели.
При аксиальном спондилоартрите без рентгенологических признаков анкилозирующего спондилита после индукционной дозы рекомендованная поддерживающая доза препарата Симзия® для взрослых пациентов составляет 200 мг 1 раз в 2 недели или 400 мг 1 раз в 4 недели.
При псориатическом артрите после индукционной дозы рекомендованная поддерживающая доза препарата Симзия® для взрослых пациентов составляет 200 мг 1 раз в 2 недели. После ответа на терапию возможно использование альтернативного режима дозирования 400 мг 1 раз в 4 недели.
Данные, полученные в исследованиях ревматоидного артрита, аксиального спондилоартрита и псориатического артрита показывают, что клинический ответ обычно достигается в течение 12 недель лечения. Решение о дальнейшем лечении пациентов, у которых терапевтический эффект не развился в течение первых 12 недель терапии, должно быть тщательно взвешено.
Пропущенная доза
Пациентам, которые пропустили введение очередной дозы, нужно рекомендовать ввести пропущенную дозу препарата Симзия® как только они вспомнили об этом, а затем продолжить введение последующих доз согласно первоначальному плану лечения.
Пациентам пожилого возраста (65 лет и старше) коррекции дозы не требуется.
Инструкция по технике выполнения подкожной инъекции
Подготовка к проведению инъекции
Перед тем, как вводить препарат Симзия® в предварительно заполненном шприце, необходимо убедиться в следующем:
на упаковке и шприце указано название препарата Симзия®;
срок годности препарата не истек;
целостность упаковки препарата не нарушена, защитные наклейки сохранены на нижней и верхней стороне картонной пачки;
препарат в шприце не был заморожен и не подвергался воздействию прямых солнечных лучей;
содержимое предварительно заполненного шприца - прозрачный опалесцирующий бесцветный или желтого цвета раствор, в котором отсутствуют видимые частицы.
Препарат не может быть использован, если хотя бы одно из перечисленных требований не соблюдено.
Каждая упаковка препарата Симзия® содержит одноразовый шприц, снабженный иглой и двумя индивидуально упакованными спиртовыми тампонами.
Для каждой инъекции используют 1 шприц и 1 спиртовой тампон.
Также необходимо дополнительно иметь 1 чистый ватный тампон (не включен в комплект препарата Симзия®) и защитный контейнер для использованных игл и шприцев, предохраняющий от получения колющей травмы при работе с иглами.
В каждом предварительно заполненном шприце содержится доза препарата, достаточная для одной инъекции (200 мг). В соответствии с назначениями врача, возможно, будет необходимо ввести препарат более одного раза. Если препарат Симзия® назначен в дозе 400 мг, то нужно выполнить 2 п/к инъекции (200 мг×2 раза). Препарат вводится под кожу в области живота или бедра. Если необходимо дважды ввести препарат, его следует вводить в анатомически различные участки (например, правая и левая сторона, или живот и бедро).
Необходимо извлечь 1 или 2 предварительно заполненных шприца с препаратом Симзия®, а также спиртовые тампоны из холодильника и поместить их на чистую ровную поверхность. До проведения инъекции необходимо дать шприцу с препаратом нагреться до комнатной температуры. Для этого потребуется примерно 30 мин.
Побочные эффекты и передозировка
Ревматоидный артрит
Наиболее часто наблюдались нежелательные реакции, относящиеся к группе "инфекций и инвазий" - у 14.4% пациентов, получающих препарат Симзия®, и у 8% пациентов группы плацебо, "общие расстройства и реакции в месте введения" у 8.8% пациентов, получавших препарат Симзия®, и 7.4% - плацебо, а также "нарушения со стороны кожи и подкожной клетчатки" у 7% пациентов, получавших препарат Симзия® и 2.4% - плацебо.
Терапия была прекращена в связи с развитием нежелательных явлений у 4.4% пациентов, получавших препарат Симзия®, и у 2.7% пациентов, не получавших препарат (группа плацебо).
Болезнь Крона
У пациентов с болезнью Крона в контролируемых исследованиях серьезные нежелательные явления отмечены в 10.8% случаев, получающих лечение препаратом Симзия®, а в группе плацебо - в 8.6%.
Наиболее частыми нежелательными реакциями были ринофарингит (11.1% и 6.7%, соответственно), тошнота (8% и 6.7%, соответственно), инфекции органов мочевыделительной системы (5.1% и 4.4%, соответственно), абдоминальная боль (9.3% и 8.8%, соответственно), артралгия (6.7% и 3.9%, соответственно), головная боль (14.8% и 13.8%, соответственно).
Из-за нежелательных реакций терапию прекратили 11.3% пациентов, получавших препарат Симзия®, и 12.6% - получавших плацебо. Наиболее частыми нежелательными реакциями, приводившими к отмене препарата Симзия®, были: диарея (0.5% и 0.2%, соответственно), боль в животе (0.9% и 0.4%, соответственно) и тошнота (0.4% и 0.2%, соответственно).
Аксиальный спондилоартрит
В плацебо-контролируемом исследовании оценивался профиль безопасности у 325 пациентов с активным аксиальным спондилоартритом, которые получали препарат Симзия® на протяжении до 30 месяцев. Профиль безопасности препарата Симзия® при применении у больных аксиальным спондилоартритом соответствовал таковому у больных ревматоидным артритом и предшествующему опыту применения препарата.
Псориатический артрит
В плацебо-контролируемом исследовании оценивался профиль безопасности у 409 пациентов с псориатическим артритом, которые получали препарат Симзия® на протяжении до 30 месяцев.
Профиль безопасности препарата Симзия® при применении у пациентов с псориатическим артритом соответствовал таковому у больных ревматоидным артритом и предшествующему опыту применения препарата.
Фармакологическое действие и фармакокинетика
Цертолизумаба пэгол - ингибитор фактора некроза опухоли альфа (ФНОα). ФНОα является основным цитокином, поддерживающим воспалительный процесс при ревматоидном артрите, болезни Крона, псориатическом артрите и аксиальном спондилоартрите. Цертолизумаба пэгол обладает высокой специфической активностью в отношении ФНОα человека (IC90 составляет 4 нг/мл для ингибирования ФНОα in vitro в процессе цитотоксического анализа клеток мышиной фибросаркомы L929), он не обладает активностью в отношении лимфотоксина α (ФНОβ).
Показано, что цертолизумаба пэгол нейтрализует связанный с мембраной и растворимый человеческий ФНОα дозозависимым способом. Инкубирование человеческих моноцитов с цертолизумаба пэголом приводило к дозозависимому ингибированию ЛПС (липополисахарид) - индуцированного синтеза ФНОα и интерлейкина-1 бета (ИЛ-1β).
Цертолизумаба пэгол не содержит кристаллизующего фрагмента (Fc), который обычно содержится в полном антителе и поэтому не фиксирует комплемент и не приводит к развитию антителозависимой клеточной цитотоксичности in vitro.
Цертолизумаба пэгол не вызывает апоптоз in vitro моноцитов и лимфоцитов периферической крови человека, а также не приводит к дегрануляции нейтрофилов.
Восприимчивость ткани к цертолизумаба пэголу была изучена в экспериментах ex vivo и in vitro, проведенных на живой ткани для оценки возможного взаимодействия между препаратом и криосрезами замороженной нормальной ткани человека. При использовании стандартного набора тканей человека, доказательств перекрестной реактивности с цертолизумаба пэголом получено не было.
Повышенная концентрация ФНОα определяется в синовиальной жидкости больных ревматоидным артритом и играет важную роль в прогрессировании воспалительных, пролиферативных и деструктивных изменений в суставах, что является основным проявлением заболевания.
Биологические свойства ФНОα включают активацию молекул клеточной адгезии и хемокинов, активацию молекул I и II класса главного комплекса гистосовместимости и прямую активацию лейкоцитов. ФНОα стимулирует образование клеточных медиаторов воспаления, включая ИЛ-1, простагландины, фактор активации тромбоцитов, оксид азота. Увеличение концентрации ФНОα играет ключевую роль в патофизиологических механизмах развития болезни Крона, ревматоидного артрита, псориатического артрита и аксиального спондилоартрита. Цертолизумаба пэгол избирательно связывается с ФНОα, подавляя его роль основного медиатора воспаления. При болезни Крона ФНОα определяется в значительной концентрации в пораженных участках стенки кишечника, а его концентрация в кале пациентов с болезнью Крона отражает клиническую тяжесть заболевания.
После лечения цертолизумаба пэголом у пациентов с болезнью Крона отмечено снижение концентрации С-реактивного белка (СРБ) в крови. На фоне лечения препаратом Симзия® у пациентов, у которых аксиальный спондилоартрит развился в зрелом возрасте, выраженное уменьшение симптомов воспаления отмечалось и в крестцово-подвздошных сочленениях, и в межпозвоночных суставах - как у всей популяции больных аксиальным спондилоартритом, так и в подгруппах пациентов с анкилозирующим спондилитом и аксиальным спондилоартритом без рентгенологических признаков.
Применение препарата Симзия® сопровождалось выраженным улучшением основных показателей эффективности, которые включали мобильность позвоночника и физические функции, интенсивность болевых ощущений, выраженность слабости и качество жизни. Пациенты с активным псориатическим артритом, который дебютировал в зрелом возрасте, продемонстрировали существенное улучшение всех основных показателей эффективности на фоне применения препарата Симзия®. На 12 и 24 неделе лечения препаратом Симзия® у больных псорическим артритом отмечалось улучшение параметров, характеризующих периферическую активность заболевания (например, количество припухших суставов, количество болезненных/скованных суставов, выраженность дактилита и распространенность энтезита). Было отмечено существенное улучшение физической функции, уменьшение артритической боли, уменьшение усталости по сравнению с плацебо. Пациенты, получающие лечение препаратом Симзия®, сообщали о значительном улучшении качества жизни.
Фармакокинетика
Всасывание
После п/к введения Cmax цертолизумаба пэгола в плазме крови достигается через 54-171 ч. Биодоступность цертолизумаба пэгола составляет около 80% (от 76% до 88%).
Распределение
У пациентов ревматоидным артритом и болезнью Крона по данным популяционного анализа параметров фармакокинетики цертолизумаба пэгола равновесный Vd оценивался в диапазоне от 6 до 8 л.
Метаболизм
Метаболизм цертолизумаба пэгола в клинических исследованиях не изучался. В экспериментальных исследованиях на животных показано, что выведение цертолизумаба пэгола, в основном, осуществляется почками.
Выведение
ПЭГилирование (ковалентное присоединение полимеров полиэтиленгликоля (ПЭГ) к белкам) способствует замедлению выведения этих соединений из кровотока вследствие различных механизмов, включая снижение почечного клиренса, снижения протеолиза и иммуногенности. Таким образом, конъюгация с ПЭГ цертолизумаба пэгола, который является Fab'-фрагментом антитела, способствует увеличению периода полувыведения (T1/2) Fab'-фрагмента до значения, сопоставимого с Тγ2 целого антитела. Т1/2 цертолизумаба пэгола составляет около 14 дней для всех изученных доз. У здоровых лиц скорость выведения цертолизумаба пэгола при в/в введении - от 9.21 мл/ч до 14.38 мл/ч. При болезни Крона клиренс цертолизумаба пэгола при п/к введении составлял 17 мл/ч по данным популяционного фармакокинетического анализа.
Аналогично, при ревматоидном артрите клиренс цертолизумаба пэгола при п/к введении составлял 21 мл/ч по данным популяционного фармакокинетического анализа.
Особые указания
Инфекции
Пациенты должны быть тщательно обследованы на наличие инфекций, в т.ч. хронических и местных очагов инфекции, до назначения препарата Симзия®, в ходе лечения и после его окончания. Принимая во внимание длительный Т1/2 препарата Симзия®, наблюдение за пациентами следует осуществлять и в течение всего этого периода.
Пациенты с впервые выявленной инфекцией на фоне лечения препаратом Симзия® должны находиться под тщательным наблюдением. При применении антагонистов ФНО, включая Симзию, сообщалось о сепсисе, туберкулезе и других тяжелых инфекциях с бактериальными, микобактериальными, инвазивными грибковыми, вирусными и/или паразитарными возбудителями.
Среди оппортунистических инфекций, наиболее часто сообщалось о гистоплазмозе, аспергиллезе, кандидозе, кокцидиоидомикозе, нокардиозе, листериозе и пневмоцистозе.
В случае развития тяжелой инфекции лечение препаратом Симзия® следует прекратить.
Перед назначением препарата Симзия® следует тщательно оценить соотношение пользы и риска данной терапии у пациентов с хроническими или рецидивирующими или оппортунистическими инфекциями в анамнезе; у пациентов, которым проводят сопутствующую иммуносупрессивную терапию; при состояниях пациентов, предрасполагающих к развитию инфекций, а также при смене места жительства или поездках в районы с высокой заболеваемостью туберкулезом, микозами, гистоплазмозом и другими инфекциями.
У больных ревматоидным артритом симптомы инфекционного заболевания могут носить стертый характер. Поэтому раннее выявление любого инфекционного заболевания, особенно атипичных клинических проявлений тяжелой инфекции, крайне важно для своевременной постановки диагноза и безотлагательного начала лечения.
Туберкулез
Как и на фоне применения других ингибиторов ФНОα при лечении препаратом Симзия® отмечались случаи реактивации туберкулеза или новые случаи туберкулеза (включая милиарный легочный туберкулез, туберкулез внелегочной локализации и диссеминированную форму заболевания). До назначения препарата Симзия® необходимо оценить соотношение пользы и риска данной терапии с учетом факторов риска развития туберкулеза. До начала лечения препаратом Симзия® всем пациентам необходимо провести обследование для исключения активного или скрытого (латентного) туберкулеза. Это обследование должно включать детальное изучение анамнеза пациента с целью исключения перенесенного ранее туберкулеза, выявления возможных контактов с больными туберкулезом, а также получения данных о проведенной или продолжающейся иммуносупрессивной терапии. Всем пациентам проводят соответствующие скриннинговые тесты, например, туберкулиновый кожный тест (или иное исследование для выявления латентного туберкулеза) и рентгенографию органов грудной клетки. Необходимо учитывать, что в некоторых случаях возможно получение ложноотрицательного результата туберкулинового теста, особенно у пациентов с тяжелым клиническим состоянием и сниженным иммунным статусом. При проведении туберкулиновой пробы размер папулы 5 мм и более считается положительным, даже если ранее проводилась вакцинация БЦЖ (бацилла Кальметта-Герена). Следует рассмотреть необходимость проведения профилактического курса лечения туберкулеза до назначения препарата Симзия® у тех пациентов, у которых, при наличии указаний на ранее перенесенный туберкулез или признаки его латентного течения, невозможно подтвердить предшествующую адекватную противотуберкулезную терапию, а также у пациентов, имеющих факторы риска развития туберкулеза, несмотря на отрицательный результат теста для выявления латентного туберкулеза. Для решения вопроса о необходимости курса противотуберкулезной терапии для каждого конкретного пациента необходима консультация врача-фтизиатра.
Передозировка
В рамках клинических исследований не зарегистрирована взаимосвязь проявлений токсичности и дозы препарата. При п/к введении препарата Симзия® в дозе до 800 мг и в/в введении в дозе 20 мг/кг симптомов передозировки не отмечено.
Лечение: в случае возникновения симптомов передозировки необходимо тщательное наблюдение за состоянием пациента и проведение симптоматической терапии.
Лекарственное взаимодействие
Одновременное применение препарата Симзия® с ГКС, нестероидными противовоспалительными препаратами (НПВП), анальгетиками, салицилатами, антибактериальными, противовирусными препаратами, а также иммунодепрессантами (азатиоприн, меркаптопурин, метотрексат) не оказывало влияния на параметры фармакокинетики препарата.
словия хранения и отпуска из аптек
Условия хранения:Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С. Не замораживать.
Срок годности препарата Симзия®
Срок годности - 2 года.
Условия реализации
Препарат отпускается по рецепту.
Регистрационные данные
Торговое название
Нейромидин®
Международное непатентованное название:цертолизумаб пэгол.
Форма выпуска:раствор для внутримышечного и подкожного введения.
Состав:Раствор для п/к введения прозрачный или опалесцирующий, бесцветный или желтого цвета.
1 мл
цертолизумаба пэгол 200 мг
Вспомогательные вещества: натрия ацетат - 1.36 мг, натрия хлорид - 7.31 мг, вода д/и - до 1 мл.
АТХ: L04AB05 Certolizumab pegol
Регистрация: Лекарственное средство ЛП-000008 от 20.10.10
Фармгруппа: холинэстеразы ингибитор* Владелец рег.удостоверения:UCB Pharma, S.A. Производитель:VETTER PHARMA-FERTINGUNG, GmbH & Co.KG Представительство:ОЛАЙНФАРМ АО.
Информация предоставлена: Компанией ГЭОТАР - http://www.lsgeotar.ru/